
关键字:FDA 多癌种多基因检测 专家点评
用时:约11分钟
北京时间2017年11月16日,美国食品和药物管理局(FDA)宣布批准MSK的肿瘤多癌种多基因检测平台:MSK-IMPACT™。这项检测由Memorial Sloan Kettering(MSK)的病理科研发。开创了肿瘤精准医疗在技术上的多基因检测之路,开创了从概念阶段到临床实践阶段、也预示着IVD和LDT创新审批之路。基因慧整理以下信息,并邀请国内知名肿瘤企业和专家对此点评。仅供参考。回复 “GSK”可获得FDA审批文件。

图片来自FDA,仅做研究用。
划重点
1、开创了精准医疗的多基因、多癌种、平台化检测之路
2、巨大样本量的性能验证、数据严谨审核的同时,行政审批向科研发展靠近
3、可能导致针对基于NGS的肿瘤多基因检测产品的保险覆盖
4、开创了医学和商业实验室开发的基因检测产品的授权先例
5、引申对类似评价MSI、TMB等提供临床准入开辟可循之路

图,David Klimstra
MSK病理学系主任David Klimstra说:“病理学几乎可以指导癌症治疗过程中的每个决策点。 MSK-IMPACT使我们的病理学家更好地了解每个病人的疾病遗传基础,通过测序获得有价值的数据可以指导治疗方案的选择,并在某些情况下可以帮助确定癌症临床试验候选入组患者。”
1、MSK-IMPACT的检测方法
法规约束 21 CFR 866.6080
用 途 多癌种临床病理诊断
检测基因 从468个基因的6284个外显子中检测体细胞突变(SNV)、小的插入缺失(Indel)微卫星突变等。
测序方法 二代测序(NGS),基于Illumina HiSeq™ 2500 测序仪平台,针对肿瘤患者的FFPE(福尔马林固定的石蜡包埋肿瘤组织)样本和正常样本。
分析方法 在生物信息分析方法中,重点之一是对于检测到的基因突变的过滤和注释。以下是MSK-IMPACT的过滤及注释流程:
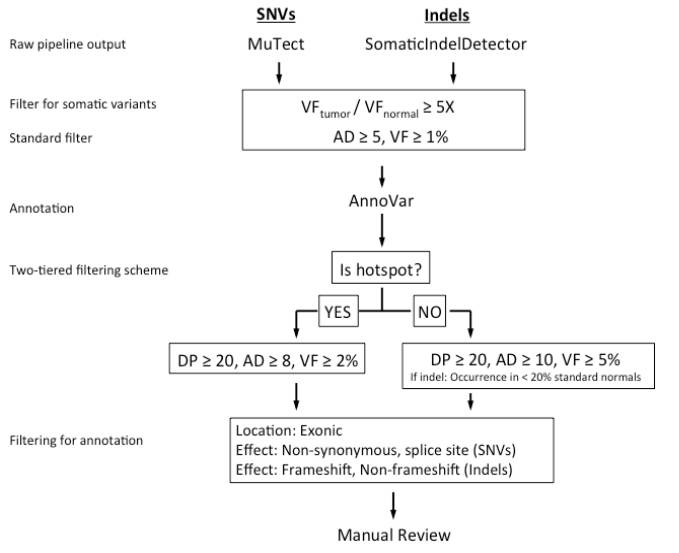
方法评估
1)覆盖度:对于433个样本的覆盖度,96.5%的样本符合≥200X的标准;
2)检出率:对于已知突变的433个样本,432个样本被成功检测出(另一个被错误过滤,过滤算法已修正);
3)热点检测一致性:对于10个基因内的33个热点(hotspot)的准确性,检测95个样本33个位置的MSK-IMPACT结果的与单一正交方法所获得的结果进行比较。109个突变和3026个野生型的变异水平一致性(PPA和NPA)为100%,双侧95%置信区间为(96.7%,100.0%);
4)微卫星不稳定性检测(MSI):详情见FDA文档(关注并在主页回复“MSK”即得)。
临床评估
MSK-IMPACT的468基因Panel与癌症发病机制、肿瘤抑制机理或癌症患者管理中的相关临床信息或医疗机械有关。该检测方法的报告分两类突变:“具有临床意义证据的癌症突变”和“具有潜在临床意义的癌症突变”符合预期临床用途。具有临床意义证据的基因突变已写入医疗专家制定的指南中。
2、MSK-IMPACT方法的特色和意义
多基因、多癌种
从2014年1月起,MSK-IMPACT被MSK用于制定晚期癌症患者的治疗方案,它基于高通量下一代测序技术,检测癌症相关基因的改变,检测范围从之前的341个基因扩展到今天的468个基因。这和2016年FDA批准 FoundationFocus™ CDxBRCA相比有着本质突破,后者聚焦检测BRCA基因,从而筛选出新药Rubraca可能有疗效的卵巢癌患者。而MSK-IMPACT覆盖468个基因覆盖更多的癌种。
推进技术转化和商业保险
MSK-IMPACT已被纽约州卫生部批准临床试验。是第一个通过FDA获得授权的肿瘤分析实验室开发的检测。这将为学术和商业实验室开发的检测方法的授权创下先例。FDA对MSK-IMPACT™的授权以及最近批准的一些药物标志着精准医学的一个新阶段。这可能会导致更广泛的对肿瘤学基因组合(PANEL)测序的保险覆盖。
实用性
今年早些时候在《Nature Medicine》杂志上发表的一项研究,前10336例MSK-IMPACT患者进行了肿瘤测序,其中近37%的患者至少有一项可治的(actionable)突变。这意味着针对这些突变的药物是可用的。根据这些测试结果,该报告报道,11%的患者(约1000人)能够参与直接针对肿瘤基因改变的治疗的临床试验。
FDA授权使用MSK-IMPACT的一个重要组成部分是MSI检测。今年5月,美国FDA批准了PD-1抗体Keytruda 用于治疗携带微卫星不稳定性高(MSI-H)或错配修复缺陷(dMMR)的成人和儿童实体瘤患者。这也是美国FDA批准的首款不依据肿瘤来源,而是依据生物标志物进行区分的抗肿瘤疗法。 MSK医学部肿瘤实验室负责人Luis Diaz领导的团队参与这个药物的临床试验。 这为此检测方法的意义又加了一分。
数据共享
所有通过MSK-IMPACT检测收集的数据,都将通过MSK开发的数据库cBioPortal提供给广泛的科学同仁。为了保护隐私,患者的身份等识别信息被删除,但包括基本的临床数据。MSK-IMPACT的数据也将通过八个前沿癌症中心参与的 AACR GENIE项目共享, GENIE(Genomics Evidence Neoplasia Information Exchange)项目由美国癌症研究协会(AACR)创建,由MSK人类肿瘤和发病机制项目主席 Charles Sawyers领导。 MSK为该项目贡献了最大比例的病人,其中包括CMO资助没有保险的患者。
3、行业专家和企业代表解读
如何解读和理解这一重大举措的意义以及对行业的影响。基因慧特邀知名专家和肿瘤企业代表参与解读讨论,分享如下(感谢各位参与,以下仅代表嘉宾观点)。

杨虎山

Sidney Kimmel癌症中心医学肿瘤学系副教授,循环肿瘤细胞中心实验室主任

“今天对于中美的肿瘤精准医疗领域都是一个非常重要的里程碑,在今天的批准说明里面,FDA的Commissioner Scott Gottlieb 特别指出,这次的批准是FDA致力于发展有创造性的,灵活的监管途径来刺激加速创新型技术的监管和落地。而且在未来,在保持安全和有效的标准下,FDA会继续寻找机会来进行更有效率的监管而促进那些对美国人民健康有利的产品和技术的临床应用。我们可以感觉到FDA对加速创新型体外诊断产品落地的决心。
这和我们中国CFDA刚刚发表的纲领性文件来加速药品和诊断试剂的批准流程不谋而合。在这些中美两国的政策和监管利好推动之下,期待在不久的将来会有更多振奋人心的产品被批准:第一,是越来越多的类似IMPACT的大规模多基因的肿瘤组织检测产品获批。第二,在某些特定的领域,例如遗传疾病或罕见疾病的筛查诊断领域,可能会有全外显子组甚至全基因组的测序解读产品获批。第三,期待着更多的液体活检相关产品的批准。在现阶段,中国只有少数几家企业的液体活检用药指导产品正在绿色审批通道上。期待着在不久的将来,基于NGS的多基因panel、甚至全基因组测序的液体活检用于无创肿瘤早期筛查诊断的产品,也会在CFDA审批的道路上得到长足的发展。由于技术上的难度和对于大量验证人群的需要,这类产品会是肿瘤精准医疗领域的皇冠上的最灿烂、也是最难摘得的一颗明珠,但对于控制我国癌症每年增长的发生率和提高病人的生存率会有最为至关重要的影响。”

任善成

海军军医大学(第二军医大学)附属长海医院泌尿外科教授 青年长江学者













