
在2023年7月的“促进民营经济发展28条”中,基因和细胞医疗与工业软件、云计算、人工智能、工业互联网、新型储能等并列为七大重大科技攻关的领域之一。有趣的是,ChatGPT创始人SamAltman于今年4月斥资1.8亿美元(约合人民币12亿元)投资细胞治疗科技企业Retro Biosciences。二者的关键词之一是细胞和基因治疗。在基因慧启动《细胞和基因治疗蓝皮书》之际,本文浅谈细胞和基因治疗到底是什么。
一、细胞和基因治疗是两件事
因为同属于生物工程,监管逻辑类似,细胞和基因治疗(Cell and Gene Therapy,CGT)经常拿来一起说。细胞和基因治疗从技术路线上严格上是两件事,即细胞治疗和基因治疗。
细胞治疗,根据美国食品药品监督管理局(FDA)(参考资料[1]),包括免疫细胞疗法、癌症疫苗以及用于某些适应症的自体或同种异体干细胞疗法(包括造血干细胞、成体和胚胎干细胞)。
基因治疗(也称之为基因疗法),是通过修改或操纵基因的表达或改变活细胞的生物学特性来进行治疗。根据我国药品监督管理局(NMPA)[2],基因治疗产品通常由含有工程化基因构建体的载体或递送系统组成,其活性成分可为DNA(质粒)、RNA、基因改造的病毒、细菌或细胞等。
细胞治疗和基因治疗的不同点,是分别从细胞层面、基因层面来进行干预和治疗疾病;共同点是均隶属于生物创新药,且接受严格的法规及规范监管(例如一般仅用于成人细胞)。
有趣的是,细胞治疗中的嵌合抗原受体T细胞免疫疗法(CAR-T),融合了基因治疗和细胞治疗,即把患者自身的免疫细胞——T淋巴细胞提出来,通过基因改造、加工、培养成达到治疗目的要求的T细胞,然后再回输到患者体内。因此,CAR-T既属于细胞治疗,也属于广义的基因治疗产品。
二、细胞治疗和基因治疗的范畴
当前阶段,细胞治疗较主要是指免疫(细胞)治疗;干细胞疗法近年发展开始加速;此外,癌症疫苗(包括树突状细胞疫苗,癌症干细胞疫苗)在极早研究阶段。
免疫治疗,通俗简化理解为两大方向,增强体内免疫细胞的“战斗值”(例如CAR-T等)以及减弱或阻止癌细胞的“攻击力”(例如PD-1/PD-L1等)。
CAR-T是通过识别细胞膜表面抗原(比如CD19)等而发挥治疗作用。PD-1/PD-L1是通过切断PD1及其配体PD-L1和PD-L2相互作用从而阻断肿瘤免疫逃逸。
基因慧(GeneClub)获悉,根据AACR 2023等会议[3],除了CAR-T,最新免疫治疗方向包括双特异性结合抗体(BiTE)、T细胞受体嵌合型T细胞(TCR-T)、抗体偶联药物(ADC,单抗与细胞毒性药物结合而成)等。
免疫治疗的对象是抗原,针对不同抗原,近年的免疫治疗方式越来越多,叠加基因编辑和合成生物学的技术,免疫治疗呈现多样化的研发趋势,是生物药创新的重大方向之一。
干细胞疗法,指的是将健康的干细胞移植到患者体内,来修复或者是替换受损的组织或者细胞,来打造治疗的目的。目前唯一既定的应用场景是造血干细胞移植。
近年,干细胞在医美等C端场景成为热点。理论上,干细胞因为其分化功能的独特性,在器官移植等再生医生上有重大的潜在医用价值,例如文首提到的ChatGPT创始人投资的Retro希望提高平均寿命10岁;但当前阶段,各国对于干细胞的审评非常谨慎,需要针对特定适应症评估其有效性和安全性。
尽管如此,近年干细胞获得较大进展。2023年4月,FDA批准首个同种异体干细胞疗法——来自以色列公司GamidaCell的脐带血细胞疗法Omisirge,用于放化疗后接受脐带血移植的12岁以上患者[4]。Omisirge被称为首个“现货型”干细胞疗法,即干细胞来自患者本身而无需其他人。
2023年6月,我国首个基因修饰脂肪干细胞治疗2型糖尿病国家重点专项获批进入临床——由上海交通大学医学院附属瑞金医院申报的人GLP-1、FGF21双因子高表达自体脂肪间充质干细胞[5];同月,国家药监局药审中心发布《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(试行)》[6]。
广义的基因治疗,从治疗策略上包括体外疗法和体内疗法。我国在2020年发布《基因治疗产品药学研究与评价技术指导原则(征求意见稿)》。
从产品策略上,基因治疗包括体外疗法和体内疗法。体外疗法,是使用整合型载体,对造血干细胞等具有持续分裂能力的细胞插入治疗性基因,侧重减小基因插入突变的风险;体内疗法,包括基因重组、基因编辑、碱基编辑等疗法,使用非整合型载体,大多通过静脉注射,侧重减小过度免疫反应;
从技术策略上,基因治疗包括以病毒等为载体的基因递送和基因编辑两大核心技术,都是针对“损坏”的基因,前者可以通俗理解为替换,后者可以理解为修复。常见基因递送载体包括腺相关病毒AAV,慢病毒,腺病毒ADV等。基因编辑是基因治疗的底层技术,从基因水平的编辑发展到碱基编辑;
我国基因治疗企业主要偏向载体生产,代表企业包括和元生物、药明生基等;基因编辑集中在海外,代表企业包括Editas,Intellia, ,Beam,Sangamo等,我国的辉大企业值得关注。
基因疗法近年较为重磅的产品,是2022年FDA批准了bluebird公司的Zynteglo基因疗法,用于治疗β-地中海贫血患者(简称“地贫”);地贫也是我国基因治疗企业的的主要产品管线之一,包括博雅辑因、瑞风生物、禾沐基因等。
由于80%以上的罕见病是由基因突变引起的,罕见病是基因疗法主要的应用场景也得到“孤儿药”的政策鼓励。全球前20大药企均布局罕见病基因疗法,仅2020年投入近300亿美元;2023年5月,FDA批准首个外用基因治疗产品——Krystal Biotech公司的Vyjuvek用于治疗营养不良性大疱性表皮松解症(DEB);7月,阿斯利康斥资10亿美元收购辉瑞旗下罕见病基因治疗产品组合。
继Editas等公司将先天性黑蒙症作为基因治疗对象后,眼科作为基因治疗的热点领域之一。近日(2023 年8月9日),专注于眼科疾病基因治疗的公司武汉纽福斯生物科技有限公司宣布完成近 7 亿元 C+ 轮融资,领投的资本中包括三家国有资本。2023年8月7日,辉大基因宣布其自主研发的新型眼科基因治疗药物HG004获得了美国FDA授予的罕见儿科疾病认定——治疗由RPE65突变引起的遗传性视网膜疾病。
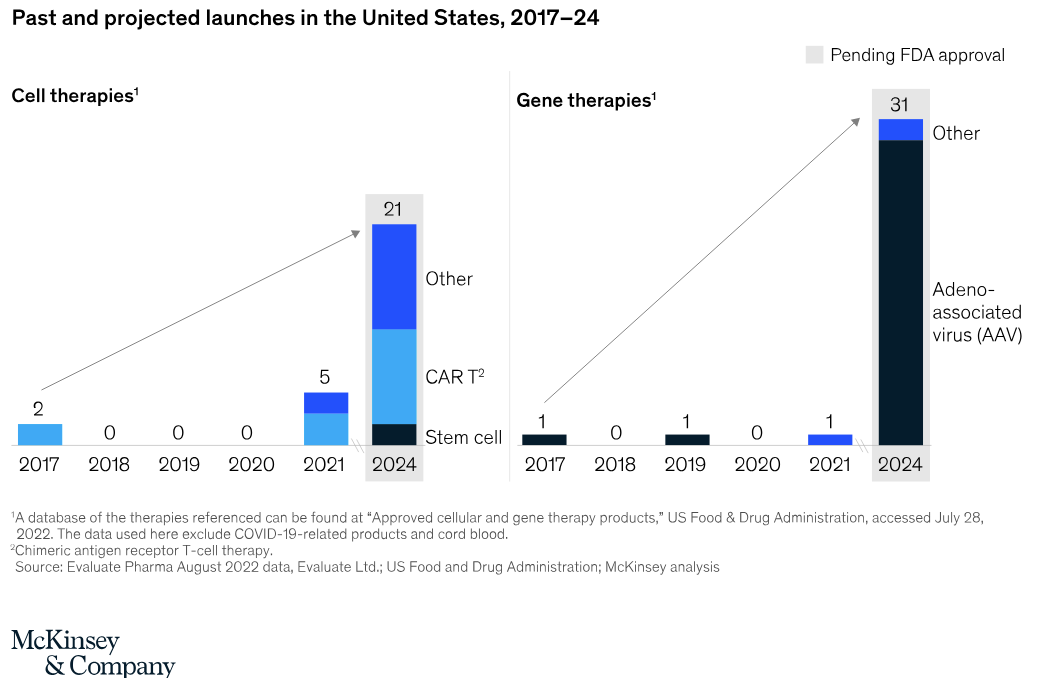
图:2017-2024年获批及可能获批的细胞治疗及基因治疗产品(来源/麦肯锡官网[7])
2023-2024年是细胞及基因治疗的关键阶段。从III期临床试验的产品管线来看,在不久的将来,获批数量可能会大幅上升。仅在 2024 年,预计将有多达 21 项细胞疗法和 31 项基因治疗启动(包括超过 29 种AAV疗法)。
麦肯锡预计,在肿瘤学领域,细胞疗法有望在2030年成为仅次于抗体和小分子的第三大细分市场,2021-2030年的销售额复合年增长率为35%。
四、人工智能加速细胞和基因治疗研发
除了ChatGPT创始人Sam Altman投资Retro Biosciences公司,亚马逊创始人贝索斯等大咖们用30亿美元“押注”Altos Labs等细胞和基因治疗领域(CGT)。其中的吸引点除了医用价值外,人工智能(AI)和细胞和基因治疗息息相关。
根据麦肯锡的观点[8],AI从以下几个方面赋能细胞和基因治疗:
基于AI设计试验,节省时间并避免不必要的昂贵实验,例如有效载荷设计优化,预测可能被治疗分子结合的肿瘤抗原靶标等;
通过机器学习来加速探寻序列、结构和功能的关系。例如预测蛋白质结构的算法(如AlphaFold),构建个性化的基于mRNA或DNA的癌症疫苗有关的免疫反应等;
将干实验和湿实验进行有效连接,打破团队孤岛,例如临床转化的端到端(E2E)数字化平台等;
……
总体而言,AI和基于AI的高级分析有望通过提高速度、减少临床故障、降低整个研发价值链的成本以及实现可持续的技术平台,成为提高细胞和基因治疗价值链研发支出回报的重要推动力。
细胞和基因治疗的最新监管政策、核心技术、代表企业、产业图谱是什么?更多内容,敬请关注基因慧近期启动的《细胞和基因治疗蓝皮书》,欢迎学会、企业、临床及科研机构等参与合作联合发布支持,推动生命科技普惠和产业融合发展。
关于基因慧>>
使连接产生价值 用数据看见未来