原创 靳悦 基因慧2023年08月02日 17:10广东

基因行业已逐渐从技术驱动发展到应用驱动,终端需求和应用场景决定着产品研发方向和产业战略。基因科技正逐步广泛应用于医疗健康以及农业(生物育种)和工业(合成生物)。本文连载《2023基因行业蓝皮书》内容,梳理基因科技在生育支持与生育健康筛查方面的应用(下一篇谈肿瘤精准医疗的应用)。
一、生育支持的迫切需求和更高要求
根据原国家卫生计生委2012年发布的《中国出生缺陷防治报告》,我国出生缺陷发生率约为 5.6%(注:2022年新生儿956万,即预计新增53.5万出生缺陷)。2022 年底的统计数据显示,我国人口61年来首次出现负增长(-0.60‰)。
这对于生育支持提出更加迫切和更高的要求。在基因科技领域,需要进一步普及无创产前基因检测,推动携带者筛查准入上市,深化辅助生殖基因检测、新生儿基因筛查辅助,同时对于多基因和环境等因素,进一步研究出生缺陷发生机制,研发识别和防止新发有害突变的方法。

二、孕前:携带者筛查
携带者筛查(Carrier Screening)能有效防控单基因病,控制出生缺陷,降低生育成本。即在孕前或早孕期,通过基因检测对夫妇双方进行遗传致病位点筛查,发现致病变异的携带者,以此预判生育遗传病患儿的潜在风险,指导生育健康。
扩展性携带者筛查在美国等发达国家已成为常规筛查手段,主要面向孕前及早孕期的夫妇;在我国,针对多个病种的携带者筛查近几年才逐渐被重视,产品有望在两年内上市。
目前扩展性携带者筛查以 NGS 技术为主,PCR、三代测序等多技术平台正逐步应用于携带者筛查。例如,郑州大学第一附属医院遗传与产前诊断中心孔祥东教授团队,通过数字PCR(dPCR)技术从男性精液中检测出常规手段难以检测的 SMA“2+0”型携带者。2021年贝瑞基因等将三代测序(长读长测序)技术应用到地中海贫血携带者筛查。
携带者筛查代表机构包括 Natera、Myriad Genetics、LabCorp、Invitae、华大基因、贝瑞基因、博圣医学、嘉宝仁和等。分子诊断公司Myriad Genetics于2018年以3.75亿美元收购 Counsyl。Myriad 公司2022年Q3营收1.57亿美元,同比增长5%,超95%检测通过线上下单,25%的订单由家庭医生进行居家检测,2023年Q3预计上市First GeneTM,将无创产前筛查与携带者筛查相结合。
携带者筛查有较大的市场增长潜力,关键点是监管准入以及临床市场的教育。
三、孕前:辅助生殖基因检测
由于生育年龄推迟以及环境压力等因素,辅助生殖的需求趋高。2018年,根据国际辅助生殖技术监测委员会(ICMART)预估,全世界有超过800万试管婴儿。预计到2100年这个数字可能达到4亿人。根据原国家卫生计生委和中国人口协会于2012年发布的《中国不孕不育现状调研报告》显示,中国不孕不育患者人数超过5000万,不孕不育率攀升到至少12.5%。
辅助生殖技术应生育健康市场需求而生,我国辅助生殖有30多年发展历史,目前可以实施世界先进水平的辅助生殖技术及衍生技术,目前获批可以实施辅助生殖技术的医疗机构有539个,仍存在一定的供给缺口。
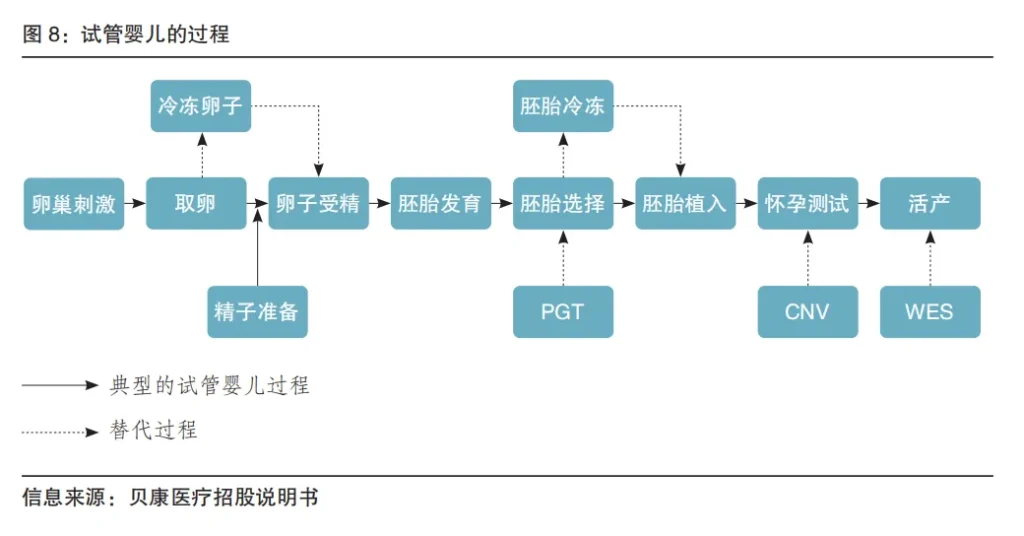
在辅助生殖过程中,植入前遗传学检测(Preimplantation Genetic Testing,PGT)针对有单基因病高风险、不良孕产史(反复流产、反复胎儿畸形)且有明确遗传学病因的夫妇,通过系统的技术方案去帮助生育一个健康孩子。根据2017年ICMART 的定义,PGT分为PGT-A(非整倍体筛查)、PGT-M(单基因疾病筛查)和 PGT-SR(染色体结构变异筛查)。其中,PGT-A 与原来的 PGS 对应,PGT-M和PGT-SR与原来的PGD对应。市面上以应用IVF-ET技术的试管婴儿为第一代,以母细胞胞浆内单精子显微注射(ICSI)技术为第二代,以PGT技术的试管婴儿为第三代。
广义的辅助生殖基因检测包括胚胎植入前基因检测(PGT)、产前基因检测(发现与遗传病相关的变异)和产后筛查(通过WES或WGS来筛查遗传病)。这里我们着重讨论PGT。
目前辅助生殖基因检测主要由有资质的生殖医学中心(医院或生殖诊所)向受检者提供检测服务。终端市场由公立医院主导,龙头机构包括中信湘雅以及锦欣生殖医疗集团,第三方基因检测公司通过直销或经销商的方式向终端提供PGT等试剂盒。
我国每年约30万名试管婴儿诞生。就每人平均三个治疗周期而言,育龄女性成功活产一次的费用约为10~12万元人民币。2022年,北京市医保局将16项辅助生殖技术纳入医保门诊报销,覆盖了约23%(即8000~10000元)的治疗费用(不包括三代技术),国家医保局在2023年表示将逐步把辅助生殖技术项目纳入医保基金支付范围。基因慧预估,辅助生殖基因检测市场规模约为68亿元。
代表性的辅助生殖基因检测公司包括 Vitrolife、Invitae、锦欣生殖、贝康医疗、亿康基因、嘉宝仁和等。Vitrolife 2022 年整体收入3.13亿美元(销售实质同比+10%),基因检测业务收入1.05亿美元。2022年锦欣生殖辅助生殖业务收入10.54亿元(同比-9%)、贝康医疗收入1.41亿元(同比+31%,试剂盒销售额占比 64%)。收购拉动Vitrolife的65% 的营收增长率,贝康医疗也于2021年收购起步较早的男科IVD诊断公司星博生物51%的股权。
目前辅助生殖基因检测赛道供不应求,但二级市场估值保守。一方面要加速产品准入、提高行业规范和渗透率;另一方面除了拓展传统新产品(比如液氮罐、超低温存储仪、单细胞测序等),还需打通产业链上下游核心环节,例如取样、体外受精、药物等。墨卓生物正推动单细胞测序成为子宫内膜容受性检测的最佳技术,提升移植成功率。此外,生产自动化值得关注。根据贝康医疗的招股说明书,产能40000人份/年的GMP厂房通过自动化仅需14人完成生产。
四、产前:无创产前基因检测
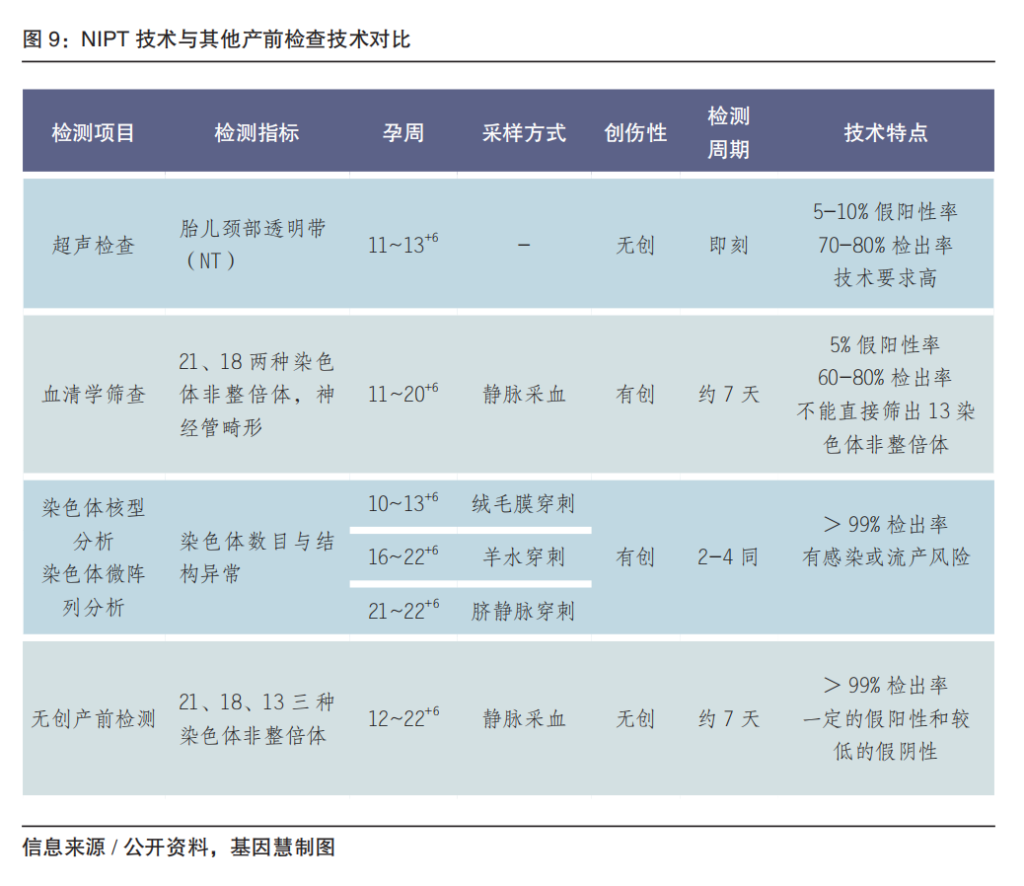
由于高龄生育以及遗传因素、环境压力、病毒感染、自身免疫性疾病等因素,总体上全球出生缺陷率增加。为控制出生缺陷,《健康中国行动(2019-2030年)》明确提出到2030年产前筛查率要达到80%及以上。常规产前筛查的假阳性高且增加因羊穿带来的流产风险,无创产前基因检测(NIPT)使得羊水穿刺等高风险侵入型产前检查率降低40%~76%。
NIPT是基因检测领域最为成熟的、应用最为广泛的现象级应用,是基因科技产品化、民生应用及产业化的典型。即通过检测母体外周血血浆的胎儿游离DNA(cfDNA),分析胎儿染色体非整倍体疾病的无创DNA检测技术。常规 NIPT检测范围包括发病率较高的 21- 三体综合征(唐氏综合征)、18-三体综合征(爱德华氏综合征)以及 13-三体综合征(帕陶氏综合征)。
NIPT常用的主流技术是 NGS,也可以采用微阵列芯片(microarray)和dPCR等技术。NIPT是筛查技术,不能作为诊断,目前灵敏度和特异性均大于99%,但以当前我国累积约超过 2000万人次的样本量级,临床上仍需注意可能产生的漏诊和误诊。
NIPT目前由医生在医疗机构开单,医疗保险或个人支付。2021年,具备平均风险的孕妇的NIPT被纳入美国联合健康保险(UHC);2013年,深圳率先在我国将NIPT纳入医保免费,其他地区约一到两千元左右。
代表性的NIPT公司包括Natera、Myriad Genetics、Verinata Health(Illumina)、Sequenom(LabCorp)、华大基因、贝瑞基因、优迅医学、博昊基因等。
当下阶段,育龄妇女规模的缩水将导致出生人口大幅下滑,NIPT企业需扩大产品适用范围和提高市场渗透率。近三年,NIPT逐渐扩展至其他染色体数目异常以及染色体微缺失/微重复领域,即NIPT-plus。国内首个NIPT-plus产品有望在2024年获批。2022年,黄荷凤院士团队在Cell Discovery期刊上发表新一代 NIPT 研究成果,实现染色体和单基因疾病同步检测。
五、新生儿基因筛查
传统的新生儿筛查以代谢物(氨基酸、有机酸、脂肪酸等)来作为标志物,通过串联质谱技术,可以在几分钟内对一个样本筛查20种以上遗传代谢病;近年NGS逐步深入应用,扩大筛查病种范围,降低假阳性,特别对于尚无可靠生化标志物的病种等方面有明显优势。对于部分疾病,快速WGS可以降低至3-7天(传统诊断4-6周时间),为每位患者节省住院治疗成本近3000美元。
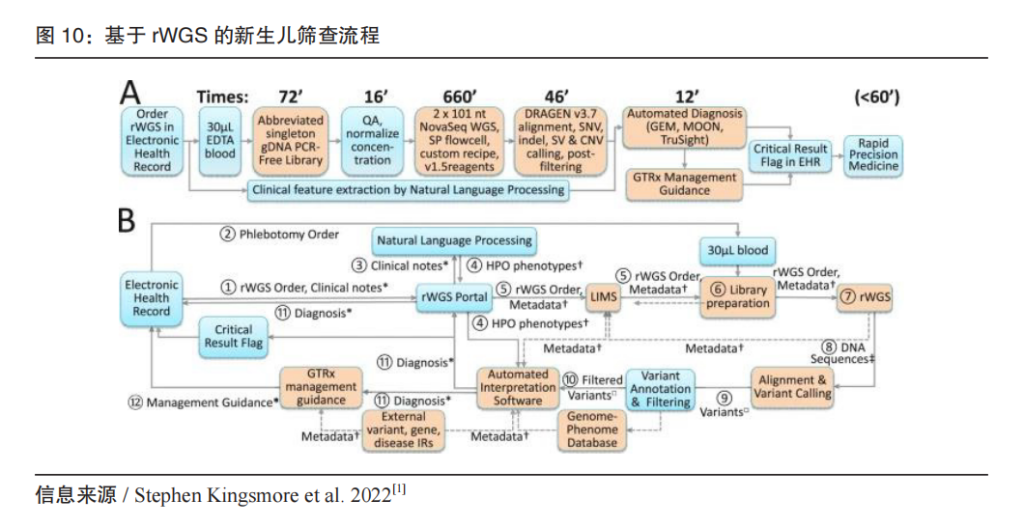
我国的新生儿基因筛查在2022年快速发展,与全球新生儿基因筛查基本同步。
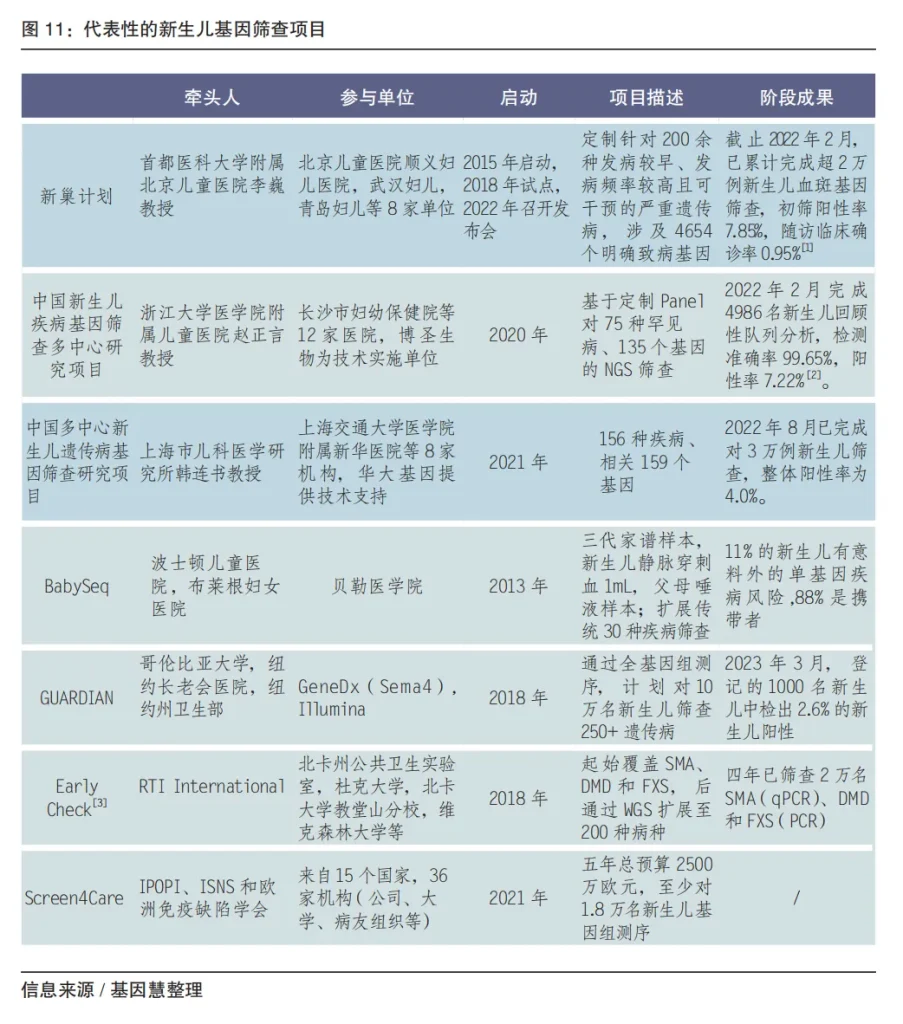
基因组测序与串联质谱、PCR 等技术一起,正成为新生儿筛查的核心技术之一,且应用比例将随着检测周期缩短、成本进一步降低而提升。2023年,英国国家医疗服务体系(NHS)宣布与英格兰基因组学公司(Genomics England)合作,计划于2023年启动新生儿基因组筛查研究项目(每年至少10万例新生儿,针对200种临床可干预的疾病)。
新生儿基因筛查在产品设计上,从质谱、PCR、靶向 panel、大panel 发展到快速全基因组(rWGS)筛查;应用层面还需进一步规范和引导,商业化仍有较长的路径,预计在2023-2024年有较大发展。
短期发展上,重点是降低筛查成本,缓解当下的公共卫生支出;其次是加速基因功能注释数据库及遗传咨询发展,建立新生儿筛查数据中心,为政策及医疗决策者提供支撑,从而推动相关产品准入及应用。
中长期发展上,在加强生命伦理规范同时,需要通过产学研更深入的协作和共同开发,给医疗机构和受检者提供更快捷、更便宜、更高灵敏度和准确率的产品菜单,强化生育支持价值;除了辅助早诊早治,基于群体队列和大样本,新生儿筛查可进一步与CRO及药企合作新药靶点发现、基因治疗研发等,提升转化研究价值,分摊筛查成本。预计到2030年,美国食品药品监督管理局(FDA)将批准至少60种细胞和基因疗法,目前有超过1000种细胞和基因治疗药物在IND阶段。
【声明】为了推动基因及数字生命健康科技推广、产业发展及政产学研用连接,基因慧秉持专业、赋能、中立的立场收集、分析及发布相关信息。但由于时效性及行业特殊性,所刊登内容仅供研究参考,未经说明不作为决策依据;本文相关信息不代表基因慧的观点;基因慧平台刊登的原创内容的知识产权为“基因慧”商标拥有者及相关权利人所有;欢迎转载,转载请申请并注明来源。欢迎个人及机构投稿及合作。

