孙兵 基因慧 2017年10月11日18:49
关键字:液体活检 ddPCR
用时:约5分钟
作者:孙冰 | 编者:Cindy | 校对:十一郎
随着无创液体活检技术的成熟和优化,国内许多机构投入了大量的人力物力来推广这一技术的应用,特别是肿瘤检测、预防和复发评估方面。这里基因慧邀请美国首都乔治城大学医学院Lombardi综合癌症研究中心癌症预防项目分子生物学专家孙冰教授和大家分享不同技术在液体活检中应用的场景及注意事项,供大家参考,欢迎留言讨论。

孙冰
美国首都乔治城大学医学院Lombardi综合癌症研究中心癌症预防项目分子生物学专家、山东大学生殖医院客座教授
1、不同技术在无创液体活检中应用
二代测序(NGS)在国内已被广泛应用于科研的各个领域和产前诊断,液体活检也不例外。质谱(MassArray)也可以用于血液无创检测,其灵敏度可达到千分之一。微滴数字化PCR,作为第三代DNA放大技术,虽被大家公认为是目前最敏感的检测方法,但实际应用中其灵敏度又和许多因素息息相关。
上面提到的三个技术,单纯根据其检测片段的大小就决定了是否适用于液体活检。目前在临床上药检局(CFDA)已经批准使用的ARMS实时定量PCR(ARMS-qPCR)法,其灵敏度也在千分之一,但其放大片段的长度决定了是否可用于血液标本的检测(解释见下)。MicroArray已被广泛应用于细胞或组织的基因表达谱(profiling)的研究。NGS也用来检测mRNA并可根据测序的结果分析基因表达的情况,而表达谱的研究则基于检测的深度(dynamic range)。NGS主要检测在表达的基因序列上是否有改变,但若用来做基因表达谱费用会相对较高。
2、ddPCR和NGS相辅相成
可以把ddPCR和NGS看成是点和线的关系。两者在应用上应该是相辅相成的。NGS是用来检测一条线上的每一点是否发生了改变,而ddPCR则是专注于检测多条线上的某一点是否发生了改变。虽然有人认为NGS的测序结果也可以用来分析某一点的改变,但这完全取决于测序的深度。
当刚拿到一个病人的肿瘤样本时,最好是能做一下NGS,帮助找到这个病人的样本中有哪些变异,而不建议仅仅根据以往文献的报道来推测某些基因可能在这个病人发生的突变。接下来要监测病人的手术或放化疗的疗效时,因为有了前面NGS测序的结果,考虑到更灵敏、更快速和更廉价,ddPCR则是很好的选择之一(如下图)。从成本和技术上,用ddPCR可相对容易达到2万x的检测深度(NGS的检测深度一般不会超过3千x)。
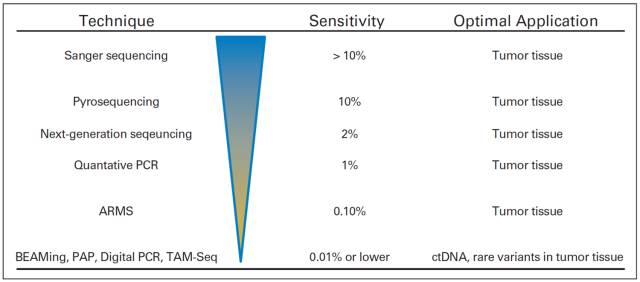
图:ctDNA检测技术比较
3、ctDNA的检测中的浓度和模板长度指标
测定血中游离的循环肿瘤DNA(ctDNA)对于肿瘤的早期诊断、药物选择和实时疗效和耐药监测有着广泛的实用价值和发展前景。
对检测的手段或技术尤其是灵敏度有很高的要求,主要是因为血中可提取到的游离DNA不多,且肿瘤DNA所占的比例很低。根据一个完整的基因组DNA大约相当于3pg,一般认为需要三倍的DNA量才能确定检测的精度,所以公认为需要10ng来做千分之一的检测。这是基于从细胞或组织中提取出完整的基因组DNA推算的。
然而,当检测的标本是血液中的游离DNA,检测模板的长度也是一个很重要的指标。比如,检测的DNA片段若在200bp以上,用在血液游离DNA的检测,即使有很多检测的靶向目标存在,但检测到的可能性不大。这主要是因为血液中的游离DNA大都是在细胞凋亡(apoptosis)过程中被降解成165bp或更小的片段(如下图)。虽然目前尚不清楚DNA在apoptosis的降解过程中的降解位点是否有特异性,但凭其随机降解后片段的大小,用于检测的DNA片段最好应控制在150bp以下。可以简单的算一下,若检测的DNA片段是55bp,相对于完整的基因组DNA,从血中游离DNA检测到的目标基因的几率降低了1/3。当检测的DNA片段增加到110bp,检测到的几率又降了1/3。所以科研人员首先需要搞清楚所选用的检测方法(试剂盒)的检测片段的大小,确定是否适用于血中游离DNA的检测,还需计算出每个检测所需用的样本量。
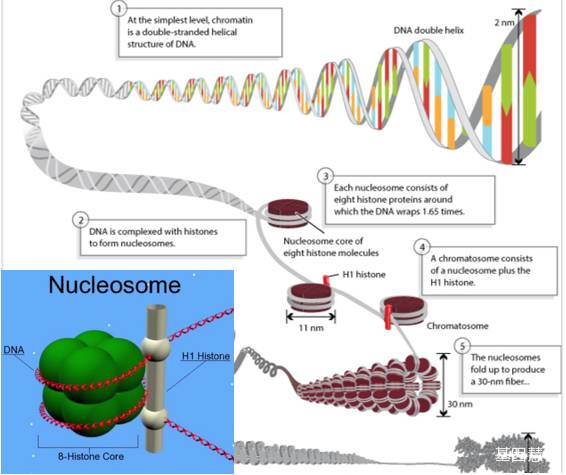
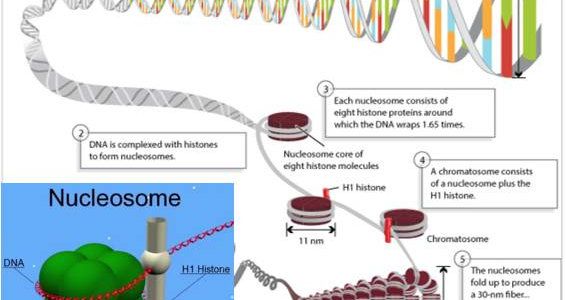
图:核小体的形成示意图
4、根据梯度PCR结果采用需要检测的标本类型
当检测反应中加入的样本量过多,则会出现另一个让人头痛的问题,那就是特异性的问题。
有经验的人一提就知道,事先用从细胞提取的基因组DNA建立起的方法和条件,当改用从福尔马林固定的蜡块组织或从血浆/血清中提取的DNA时,PCR放大往往会或多或少出现一些非特异性。当厂家推销试剂盒时提到曾将阳性标本稀释1千甚至1万倍而仍能检测的出时,应该明确一下是用什么样的标本来做稀释。
当你自己在优化反应条件时,不妨根据梯度PCR的结果,找到最高的(stringent)退火(annealing) 温度,并直接采用需要检测的标本类型来进行优化。另外,就是考虑在3到5个PCR循环放大后,降低解链(denature)的温度至只能够使得前几轮放大的小片段足以解链就可。
取血样做液体活检时还要保证样本新鲜。基本原则是室温下抽血后4小时内将血浆分离完毕低温冻存,或用特制的抽血管如Qiagen公司的PAXgene取样管,其目的就是避免由血中白细胞长时间存放后释放出的基因组DNA污染血浆中的游离DNA,造成进一步降低肿瘤基因被检测到的几率。
还有一点就是对于提取血中游离DNA试剂盒的选择。有的公司的试剂盒更倾向于从血浆/血清中提取纯化较大片段的DNA,因此并不适用于血液液体活检的要求。
5检测目的决定检测原则和确定检测方式
肿瘤治疗后抽血检测是否复发,这实际上是个定性的检测。也就是说在抽取的这管血样中我们希望知道是否有肿瘤来源的DNA,只要试管里有一个肿瘤来源的DNA我们就应该用我们的检测方法查到它,不是假阴性也不是假阳性。但在实际ddPCR检测中,即使一次查到了一两个阳性的微滴,而由此做出诊断还是蛮困难的。通常情况下,需要加大样本量和增加检测的位点来予以重复确认。另一种处理则是考虑首先做预放大,然后再用ddPCR进行检测,这是因为ddPCR本身已不再像普通PCR一样具有放大的作用,它只是一个计数DNA的方法。在做预放大进行检测时,特别要注意避免环境来源的污染,将样本与检测试剂妥善的分开处理和存放。
当需要监测治疗的疗效或病情的进展时,检测的原则是不仅需要较高的灵敏度还需要准确的定量。循环中游离的肿瘤DNA,因为其半衰期只有1个半小时左右,而且其进入血循环是一个持续的过程,其在血中的水平可以很准确的用来反映疾病的进展情况。ddPCR技术,因为是直接计数来绝对定量而不需要内控标准品做定量参考,在加之较容易的判读,在液体活检应用中较ARMS-qPCR法显示出明显的优势。又因为其灵敏度高而检测费用低再加之结果报告周期短,在这一点上比NGS更有实用价值。
行研咨询
投创未来 数字健康产业格局 | 36位CEO年中总结 | 微生物组 | 基因科普 | 肿瘤精准医疗 | 合成基因组 | 罕见病 | 液体活检共 | 全球46家基因云平台 | 2016年基因行业投融资总结 | 基因慧为《基因组革命》作序 | 12家上市公司Q2财报 | 24家基因相关上市公司盘点 | “基因+X”跨界产业分析 | 2016基因行业技术热点
明日之星 华大基因 | illumina | 贝瑞基因 | Embark | Veritas | 23andMe | Celularity | Helix | 誉衡基因 | GeneDock | iGeneTech
大咖论健
临床篇 政协委员北大一院-丁洁 | 复旦儿科医院-黄国英院长 | 北大国际医院-梁军院长 | 协和-黄尚志 |中日医院-顾大夫 | 陆国辉/王若光/张学 | 哈佛医学院-沈亦平 | 南京总医院-李宁 | 辛辛那提儿童医院-黄涛生 | 解放军总医院-杨云生 | 浙大一院-祁鸣 | 复旦儿科医院-王艺院长 | 齐鲁医院-李延青副院长 | 西南医院-梁志清 | 湘雅医院-詹显全 | 华大基因-王威 | 王奕鸥 12位基因诊断大咖 产业篇 华大股份CEO-尹烨 | Illumina 总经理-赵瑞林 | 明码生物-孙洪业 | 奕真生物-赵奕宁 | 泛生子-阎海 | 海普洛斯-许明炎 | 思路迪-熊磊 | 红杉中国-杨云霞 | 松禾资本-张云鹏 | 柴映爽 | 瀚海基因-贺建奎 | 精准基因-张浩 | 锐翌生物-秦楠 | Veritas -赵奕宁 | 京东云王直 | 阿里云林河山 | 荣之联-王东辉 | WeGene-陈钢 | 基云惠康-郝向稳 | 23魔方-周坤 | 12位产业界CEO专访 科研篇 华西医院-魏于全院士 | 高福院士 | 转化医学联盟主席-李继承 | 国家生物医学分析中心-杨瑞馥 | 北京基因组所-方向东 | 复旦大学-马端 | 上海交大-施奇惠 | 癌症科普作家菠萝 | Sidney Kimmel 癌症中心-杨虎山 |国家基因库-沈玥 | 南方科技大学-戴俊彪 | 国家基因库测序仪研发-蒋慧 | 机器学习和生物大数据-鲁兴华
基因三人行
临床基因检测 黄尚志/顾大夫/王奕鸥 | 生物云平台 华大基因/明码生物/聚道 | 肿瘤精准医疗 协和/吉因加/优迅医学 | 微生物组 陆祖宏/热心肠先生/赵柏闻 | 个人基因组 陈钢/郝向稳/汪亮