
本文是基因慧连续七年发布的《基因行业蓝皮书》(下载链接)连载的第五篇,一览细胞和基因治疗技术、应用和产业。2025年的《基因行业蓝皮书》启动中(首发中英双语版),欢迎企业/园区/学会合作及赞助联合发布。
(原文完稿于2024年7月,发布于2024年9月公开发布的《基因行业蓝皮书(2024-2025)》,略有改动。仅作为研究参考,不作为临床诊疗用。)
一、市场需求
细胞和基因治疗(Cell and Gene Therapy, CGT)是生物药前沿方向。CGT的本质是对于严重难治性的疾病,从表征追溯到基因或细胞,从源头修复受损基因或细胞来治疗疾病,具备精准治疗、长久受益的特点。2017年,首个CGT产品Kymriah获FDA批准;2024上半年,全球共3款细胞和基因疗法首次获批,近年来的技术及监管保持对CGT的积极态势。
国家发改委2023年发布的“促进民营经济发展28条”中,基因和细胞医疗与工业软件、云计算、人工智能、工业互联网、新型储能等并列为支持民营企业参与的重大科技攻关领域。同年,ChatGPT创始人Sam Altman斥资1.8亿美元投资细胞治疗企业Retro Biosciences。
二、细胞和基因治疗的含义
细胞治疗和基因治疗独立又有紧密联系,美国FDA及我国NMPA把二者组合成细胞和基因治疗来监管(欧盟归类为先进治疗药物)。基因慧认为,细胞和基因治疗是基于治疗疾病或康复的目的,通过修复受损基因或细胞并整合到生命体中,来恢复组织或生物正常功能的一项生物技术。细胞和基因治疗与基因编辑、免疫治疗、再生医学、创新药等概念紧密相关。
在细分的描述中,细胞和基因治疗包括以CAR-T为代表的细胞治疗和以基因编辑为代表的基因治疗。近年,细胞和基因治疗的范围延展到癌症疫苗、干细胞和核酸药物,限于篇幅,这三类在本蓝皮书中不作阐述。
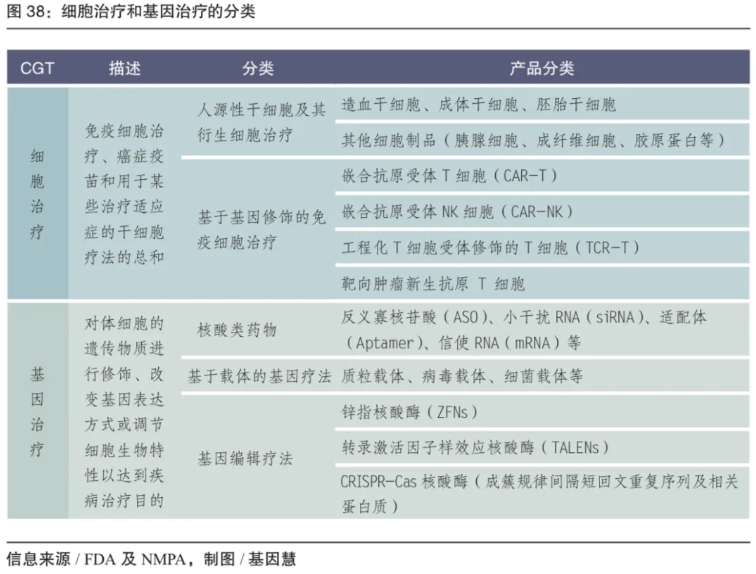
图:细胞治疗和基因治疗的分类
(来源/ FDA及NMPA,制图/基因慧)
还有一种描述细胞和基因治疗的分类,即体外疗法和体内疗法。其中,体外疗法使用整合型载体,通过造血干细胞等具有持续分裂能力的细胞插入治疗性基因,侧重减小基因插入突变的风险;体内疗法则用非整合型载体,大多通过静脉注射,侧重减小过度免疫反应。
三、应用
细胞和基因治疗的主要应用领域是严重的遗传病/罕见病以及复发性、难治性的肿瘤。其中,基因治疗主要应用遗传病/罕见病,在我国,临床试验中的基因治疗适应症主要包括输血依赖性β地中海贫血、脊髓性肌萎缩症、镰状细胞病、血友病、杜氏肌营养不良、先天性黑矇眼科疾病等。 以输血依赖性β地中海贫血为例,传统治疗方案需要定期输血、长周期的治疗费用昂贵且容易产生副反应。
基因治疗的原理是,基于珠蛋白链合成缺失造成溶血性贫血的原理,首先从病人的外周血中提取造血干细胞,然后利用病毒载体将正常的珠蛋白基因导入其中,使细胞恢复正常,再将改造后的造血干细胞回输给病人。
细胞治疗目前主要应用难治性、复发性血液肿瘤,代表疗法之一嵌合抗原受体 T 细胞疗法 (CAR-T),原理是向免疫T细胞导入修饰或改变的基因,使 T 细胞表达“定位导航装置”——肿瘤嵌合抗原受体(CAR),产生识别特定肿瘤细胞的能力,并结合 T 细胞自身的免疫效应来共同作用于肿瘤细胞。此外值得关注的是,首款治疗实体瘤的TCR-T细胞疗法Afamitresgene autoleucel有望在2024年获批,用于治疗滑膜肉瘤和粘液样/圆细胞脂肪肉瘤。
(1) 批准的CGT临床试验
在CGT临床实验方面,根据国家药品监督管理局药品审评中心(CDE)发布的《中国新药注册临床试验进展年度报告(2023年)》,2023年共登记81项CGT临床试验,较2022年增长76%,以国内临床试验为主(76 项,94%),适应症以抗肿瘤药物为主(42 项, 52%),试验分期以I期临床试验为主(33 项,41%),III期临床试验占比仅为 5%(4/81),罕见病临床试验数量逐年增加(同比增长43%)。
根据CDE官网,基因治疗临床试验默示许可的包括诺华开展的SMA基因治疗,强生开展的RPGR致病性变异相关X连锁型视网膜色素变性的基因治疗等临床试验。
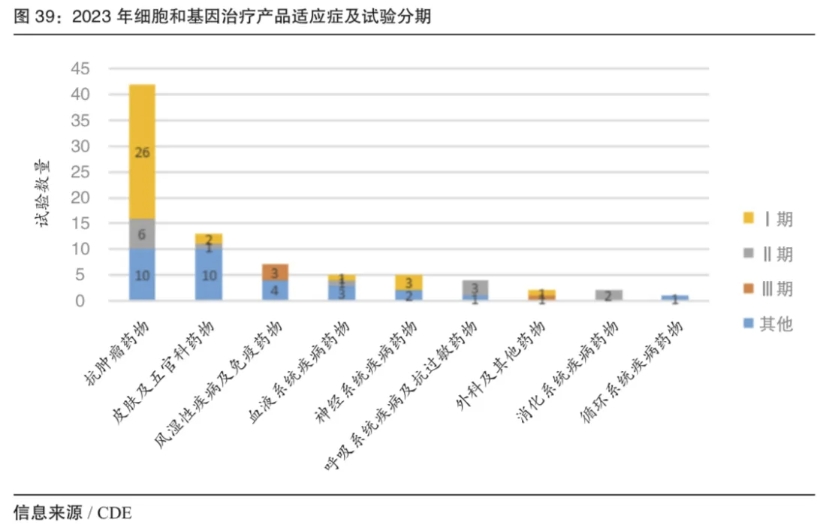
图:2023 年细胞和基因治疗产品适应症及试验分期(来源/CDE)
(2) 上市的CGT产品
在已批准上市的CGT产品方面。我国至今共批准了7种细胞和基因治疗产品上市,主要是针对多发性骨髓瘤、B细胞急性淋巴细胞白血病等血液瘤的CAR-T疗法。基因治疗方面在2004年在全球率先探索批准了首批基因治疗产品,分别是基于腺病毒载体和溶瘤病毒的基因治疗,均针对于晚期鼻咽癌。
截止2024年4月26日,FDA共批准了37种细胞和基因治疗。在细胞治疗产品中,除了细胞制品和脐带血干细胞疗法,90%是针对淋巴瘤和骨髓瘤的CAR-T;在基因治疗产品中,基于慢病毒载体和AAV病毒载体的基因疗法各占1/3。值得关注的是,首个CRISPR基因编辑疗法在2023年获得FDA批准上市。
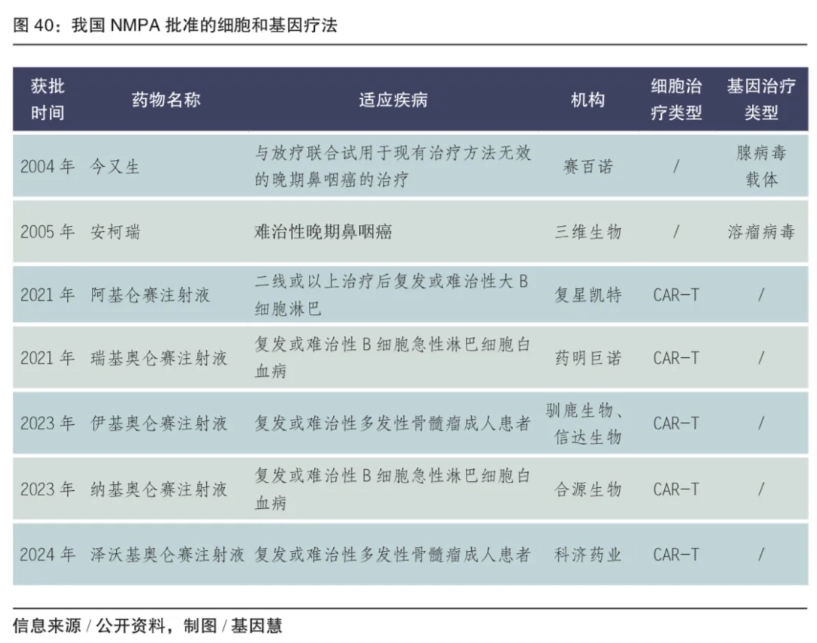
图:我国NMPA批准的细胞和基因疗法
(信息来源/公开资料,制图/基因慧)
我国在CGT领域的监管起步较早,2020年至今加速优化监管框架。2003年,原国家食品药品监督管理局(SFDA)发布《人体细胞治疗研究和制剂质量控制技术指导原则》;2004年世界上首个基因治疗药物重组人p53腺病毒注射液“今又生”获得SFDA的批准上市。
2020年开始,NMPA逐步发布非临床研究与评价、临床试验技术指导、产品临床药理学研究等方面的指导原则,特别专门发布免疫细胞治疗、基因修饰细胞治疗、人源性干细胞及其衍生细胞治疗、重组腺相关病毒载体类体内基因治疗等技术以及罕见病、血友病等应用领域的指导文件。2024年6月,国家药监局评审中心(CDE)在《中国食品药品监管》期刊上发文,探索我国先进治疗药品的范围和分类,细胞和基因治疗产品有望划入先进治疗药品行列。
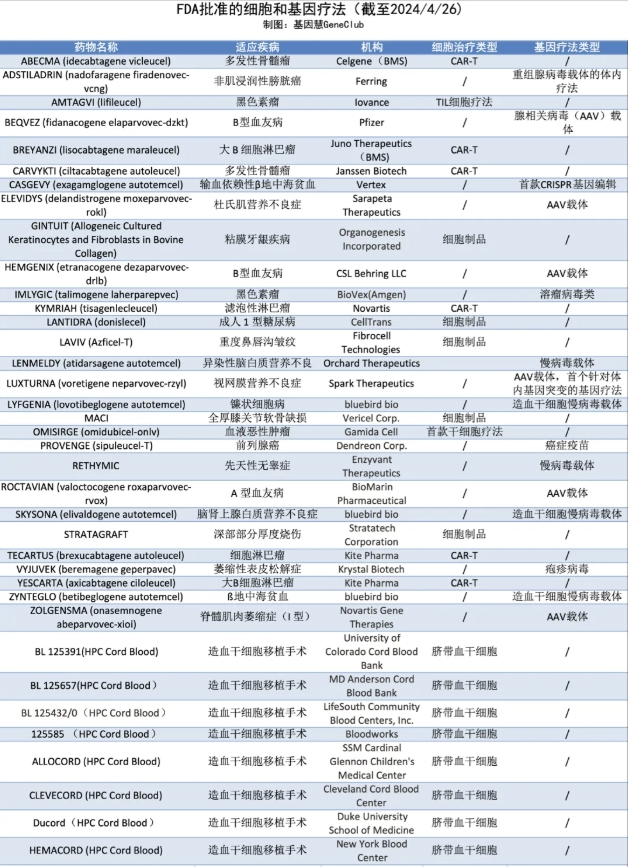
图:FDA批准的细胞和基因疗法
(信息来源/FDA官网,制图/基因慧)
四、技术
从原理上,细胞治疗和基因治疗的本质一样,即修复或替换受损细胞或基因,但因为行使功能的不同,在技术路线上有较大不同,以下分别简要阐述(限于篇幅,更多详情可以参考基因慧往期的蓝皮书以及定制咨询报告)。
细胞治疗的范围较广,从以上分类上包括免疫细胞治疗、干细胞治疗以及其他细胞制品(成纤维细胞、胰腺细胞等)。免疫细胞主要包括T细胞、NK细胞以及巨噬细胞。在本CGT章节,我们主要讨论基因修饰的免疫细胞治疗(例如CAR-T)以及PD-1基因敲除的自体T细胞制剂。
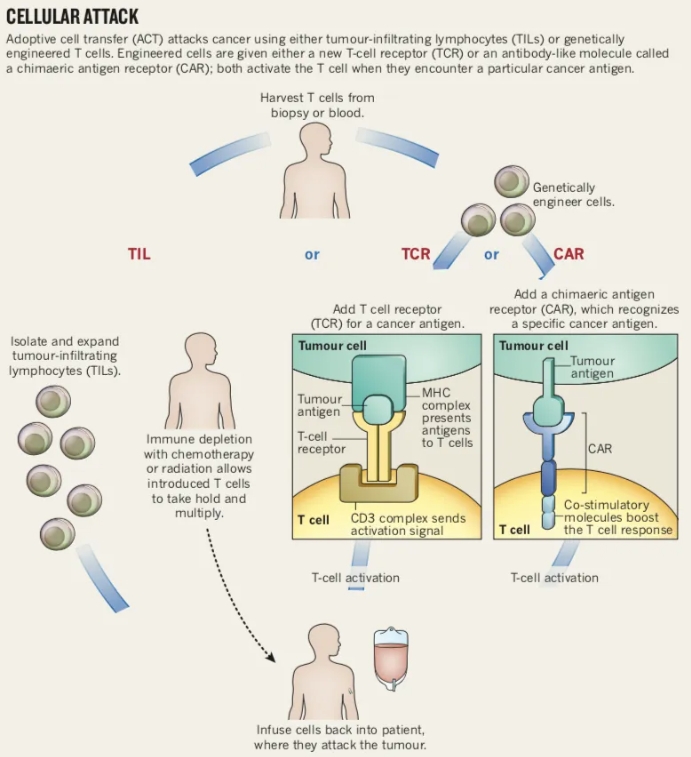
图:细胞治疗示意图
(来源/DOI: 10.1038/504S13a)
CAR-T的原理是提取病人的自体T细胞,将T细胞通过基因工程修饰后加上嵌合-抗原受体并回输体内,精准识别攻击带有靶点抗原的肿瘤细胞,并引发免疫反应。CAR-T结合了细胞治疗以及基因治疗技术,是非常典型的CGT技术。
自1989年起,CAR-T逐步演进:第一代只有T细胞刺激因子,没有共刺激因子;第二代只有单个共刺激因子;第三代有两个共刺激因子;第四代在到达肿瘤微环境后释放免疫调节剂(例如细胞因子)吸引更多的免疫细胞攻击肿瘤。
基因治疗的本质是通过修复或替换受损基因来治疗疾病。具体路径包括两种:
(1)导入外源正常基因,以纠正或补偿异常基因引起的缺陷,即基于载体的基因治疗;
(2)直接修复异常基因,使其恢复正常结构和功能,即基于基因编辑的基因治疗。基因编辑技术和载体的详细介绍请见技术章节部分。
基因编辑技术和载体的详细介绍,请见《基因行业蓝皮书》的技术章节部分(后续连载)。
五、产业
细胞和基因治疗在产业层面的导向是生物医药研发,依赖政策支持、研发投入和供应链。二者往往独立研发,也有较高的业务关联度。
细胞治疗方面,商业模式相对成熟。国外以辉瑞、礼来等传统巨头药企研发为主,通过临床注册上市,与医院合作的路径进行销售。保险公司参与支付,有分期付款模式以及按疗效付款等灵活的支付方式。
国内细胞治疗在发展早期,2021-2024年间批准上市的5款CAR-T产品,均来自于生物药企(包括复星凯特、药明巨诺、驯鹿生物/信达生物、合源生物、科济药业等),头部药企部分通过原研产品的技术引进。例如阿基仑赛注射液是复星凯特从美国Kite引进Yescarta®技术,并获授权在中国进行本地化生产,定价为120万元人民币/针,国外定价约250万元人民币/针。对照国内外购买力及定价,我国细胞治疗产品有进一步降低成本的空间及需求,包括原研技术创新、供应链优化及规模效益等,需要商业保险等模式减轻患者的负担。截至成稿日,科济药业-B(HK.02171)、药明巨诺-B(HK.02126)的总市值分别为25.90亿港元、7.84亿港元。
基因治疗方面,涉及载体等生产,高度依赖外包。国外基因治疗的产品模式以头部药企的内部研发和并购为主,销售走医院渠道。国内目前没有新一代的基因治疗产品上市,大部分在近两年刚刚获批IND(新药临床试验申请)。商业模式目前以CDMO(合同研发及生产组织)为主。
国内基因治疗代表企业包括药明康德、金斯瑞生物科技、康龙化成、和元生物、百普赛斯、博腾股份等,提供 GMP质粒、AAV、慢病毒、腺病毒、溶瘤病毒等载体以及基因治疗的药物开发服务。其中,金斯瑞蓬勃生物在2021年获得高瓴资本1.5亿美元A轮融资,据公开信息报道投前估值约7.3亿美元,2024年在江苏省镇江市启动占地面积2万余平米的抗体蛋白药&病毒商业化GMP生产中心。除了扩大基地,国际化布局也是我国基因治疗企业的特色。药明康德通过收购欧洲的OXGENE,成为在欧洲、美国、亚洲均有布局的全球性CGT CDMO公司。百普赛斯2024年在苏州启动GMP级别总面积1.7万余平方米的生产厂房,在瑞士新设子公司Acro AG,扩大全球研发布局。
【致谢】
黄荷凤院士、卢光琇教授作序推荐。感谢星云基因、华大智造、赛福基因、鹍远生物对《基因行业蓝皮书(2024-2025)》的大力支持,得以公开免费发布和传播。
【说明】
《基因行业蓝皮书》由基因慧联合合作伙伴向公众免费、公开发布电子版及纸质版,均未对外销售或授权任何第三方销售。
《基因行业蓝皮书2025》启动合作
~首发中英双语版~
90%的头部基因机构曾参与合作
欢迎企业/园区/学会等联合发布
联系:lily@genonet.cn

基因慧蓝皮书系列发布情况举例

作序专家
黄荷凤院士
卢光琇教授

作序专家
詹启敏院士

作序专家
陈润生院士

作序专家
欧阳颀院士
元英进院士
杨焕明院士
樊春海院士

作序专家
樊嘉院士等
作序专家
樊嘉院士等

作序专家
宁光院士、国家信息中心新兴产业处副处长张振翼等

作序专家
陈润生院士等

作序专家
张泽民教授

作序专家
国家卫健委医药卫生科技发展研究中心原主任李青等

作序专家
国家卫健委医药卫生科技发展研究中心原主任李青、WHO遗传病社区控制合作中心黄尚志教授
【声明】为了推动生命科技普惠和生物产业发展,基因慧秉持专业、赋能、中立的立场收集、分析及发布相关行业信息;但由于时效性及技术迭代特殊性,所刊登内容仅供研究参考,不作为临床诊疗及投融资等决策依据。本文相关信息不代表基因慧的观点。基因慧平台刊登的原创内容的知识产权为“基因慧”商标拥有者及相关权利人所有;欢迎转载,转载请申请并注明来源。欢迎在基因慧平台合作推广先进的技术、产品及市场成果以及产业规划、行业咨询及市场调研。
基因慧
通过专业咨询平台,提供独立市场洞察解决方案,助力卓越市场表现和生物产业融合普惠。
773篇原创内容

